Nova pravila EU o procjeni zdravstvene tehnologije (HTA) otvaraju novu eru za dostupnost inovacija pacijentima!
redba o procjeni zdravstvenih tehnologija (HTA) postala je primjenjiva od 12. siječnja 2025., čime će se značajno poboljšati osiguravanje dostupnosti inovativnih i učinkovitih zdravstvenih tehnologija pacijentima diljem EU-a.
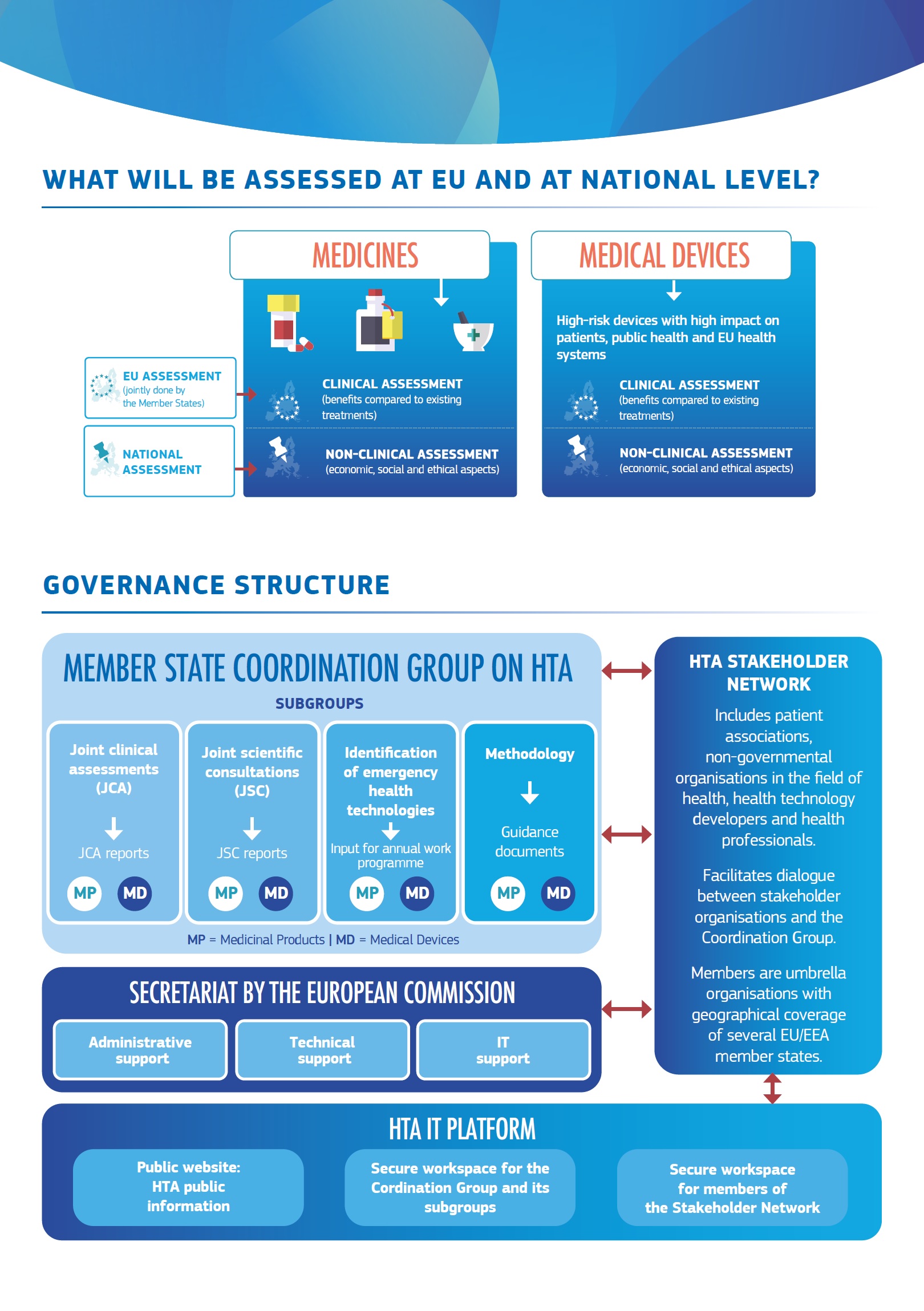
Nova pravila stvaraju okvir EU za procjenu zdravstvenih tehnologija, kao što su lijekovi i medicinski uređaji, poticanjem suradnje i koordinacije između država članica EU-a. To će pomoći nacionalnim tijelima da donesu pravodobnije i utemeljenije odluke o cijenama i naknadi zdravstvenih tehnologija te pojednostave postupak za programere zdravstvenih tehnologija. To će doprinijeti bržem i širem pristupu novim i učinkovitijim inovativnim proizvodima za pacijente.
“Nova pravila stvaraju okvir EU za procjenu zdravstvenih tehnologija te će doprinijeti bržem i širem pristupu novim i učinkovitijim inovativnim proizvodima za pacijente…”

Pravila će se primjenjivati na tvrtke koje traže odobrenje za stavljanje u promet svojih proizvoda uvođenjem novog i trajnog okvira EU-a za ocjenu zdravstvene tehnologije, uključujući putem:
- uvođenje jedinstvene datoteke za podnošenje na razini EU-a za zajedničke kliničke procjene kako bi se osiguralo udruživanje resursa na razini EU-a i jačanje znanstvene kvalitete HTA-a diljem EU-a uz izbjegavanje udvostručavanja ocjena na nacionalnoj razini.
- uspostavljanje bržih postupaka koji zahtijevaju dovršetak zajedničkih kliničkih procjena u roku od 30 dana nakon odobrenja lijeka;
- sustavno savjetovanje s pacijentima i kliničarima tijekom pripreme procjena, kao i uključivanje i savjetovanje s HTA dionicima.

Photo by Freepik
Kao prvi korak, počevši od 12. siječnja, ova nova pravila primjenjivat će se na zahtjeve za odobrenje za stavljanje u promet novog lijeka protiv raka ili lijeka za naprednu terapiju (ATMP). Pravila će se proširiti na lijekove za rijetke bolesti u siječnju 2028., a od 2030. pokrivat će sve nove lijekove. Odabrani visokorizični medicinski uređaji također će se procjenjivati od 2026.
Novi okvir EU-a zamjenjuje dugogodišnju projektnu suradnju između država članica na procjeni zdravstvene tehnologije koju financira EU, uz potpuno poštovanje odgovornosti država članica za upravljanje njihovim zdravstvenim uslugama prema zahtjevima njihovog nacionalnog konteksta.

“Procjena zdravstvene tehnologije znanstveni je proces utemeljen na dokazima koji ima za cilj informirati stvaranje sigurnih i učinkovitih zdravstvenih politika sažimanjem informacija o medicinskim, društvenim, ekonomskim i etičkim pitanjima koja se odnose na korištenje zdravstvene tehnologije.”
Procjena zdravstvene tehnologije znanstveni je proces utemeljen na dokazima koji ima za cilj informirati stvaranje sigurnih i učinkovitih zdravstvenih politika sažimanjem informacija o medicinskim, društvenim, ekonomskim i etičkim pitanjima koja se odnose na korištenje zdravstvene tehnologije.
Europska komisija donijela je svoj prijedlog Uredbe o ocjeni zdravstvene tehnologije 31. siječnja 2018. Usvojena u prosincu 2021. Uredba, kao ključni rezultat Farmaceutske strategije EU-a, stupila je na snagu u siječnju 2022. Primjenjuje se od 12. siječnja 2025. Tijekom ovog trogodišnjeg prijelaznog razdoblja, Komisija i države članice pripremile su uspostavljanje potrebne strukture upravljanja i izradile pripremne dokumente za podržati učinkovitu aplikaciju.
![]()
Photo by Freepik
REFERENCES:
https://ec.europa.eu/commission/presscorner/detail/en/ip_25_226

REFERENCES //
https://health.ec.europa.eu/health-technology-assessment/regulation-health-technology-assessment_en
https://health.ec.europa.eu/system/files/2023-05/hta_regulation-implementation_factsheet_en.pdf






