Vizija precizne onkologije 2030. // Preporuka OECD o dostupnosti precizne onkologije i prateće dijagnostike
ealth Hub je organizirao Policy & Diplomacy Forum “Vizija precizne onkologije u RH i EU za bolje ishode liječenja // Vizija 2030.” s brojnim sudionicima zdravstvenog ekosustava. Kao think tank promičemo dijeljenje najboljih europskih praksi i kreiranje konstruktivnog policy dijaloga, stoga pokrećemo niz aktivnosti uz nacionalne i međunarodne dionike, kako bismo kroz posebnu think tank koaliciju (koja okuplja brojne partnere) za preciznu medicinu dali vjetar u leđa postojećim platformama i inicijativama te iznjedrili kvalitetne zaključke i poziv na akciju.
Sveobuhvatni cilj sastanka bio je je olakšati suradničke rasprave među ključnim dionicima u onkologiji, patologiji, zdravstvenoj administraciji i kliničkoj praksi kako bi se osigurala spremnost zdravstvenog sustava za evoluirajući krajolik precizne onkologije. Ciljevi sastanka su bili sljedeći:
- Identificirati trenutne prioritetne prepreke i izazove u implementaciji precizne onkologije i testiranja biomarkera u kliničkoj praksi.
- Razviti djelotvorne strategije i sljedeće korake za rješavanje postojećih prepreka za punu integraciju precizne medicine u rutinsku kliničku skrb.
- Raspraviti i definirati buduće potrebe i zahtjeve za preciznom onkološkom dijagnostikom i liječenjem, osiguravajući da je zdravstveni sustav opremljen za prilagodbu i razvoj.
- Poticati međusobnu suradnju i razmjenu znanja i iskustava angažiranjem vanjskih stručnjaka i izlaganjem najboljih praksi iz naprednih implementacija u drugim zemljama.
- Definirati specifične aktivnosti i dodijeliti odgovornosti relevantnim stranama za kratkoročne i dugoročne inicijative usmjerene na povećanje spremnosti zdravstvenog sustava za preciznu onkologiju.

Access to oncology medicines in EU and OECD countries izrađen je uz financijsku pomoć Europske unije, kao dio Europskog registra nejednakosti protiv raka, vodeće inicijative Europskog plana za borbu protiv raka. Registar pruža čvrste i pouzdane podatke o prevenciji raka i onkološkoj skrbi za prepoznavanje trendova, razlika i nejednakosti između država članica i regija. Suradnja s Glavnom upravom Europske komisije za zdravlje i sigurnost hrane (DG SANTE) bila je ključna za izradu ovog dokumenta OECD-a.[i]
Adresiranje potencijalnih prepreka koje onemogućuju pacijentima dostupnost lijekovima (koji se već financiraju) i novim lijekovima protiv raka od ključne je važnosti za poboljšanje kvalitete skrbi. To uključuje osiguravanje odgovarajućih javnih proračuna za lijekove koji se plaćaju, zajedničku odluku o financiranju lijekova s pratećom dijagnostikom (tzv. companion diagnostics), redovito ažuriranje lokalnih kliničkih smjernica i protokola, kontinuiranu izobrazbu djelatnika te odgovarajuću infrastrukturu i kadar za dijagnostičko testiranje i liječenje.

Terapija raka postaje sve više individualizirana, uz odmak od pristupa „jedna veličina odgovara svima) te se temelji na tkivu s izvorištem tumora. Analiza OECD-a svih odobrenja EMA-e za nove indikacije za solidne tumore pokazala je da se gotovo polovica (47%) svih odobrenja između 2015. i 2020. temeljila na određenom biomarkeru (Falcone et al., 2022.). Testiranje biomarkera stoga je ključno za prepoznavanje pravog pacijenata za ciljano liječenje.
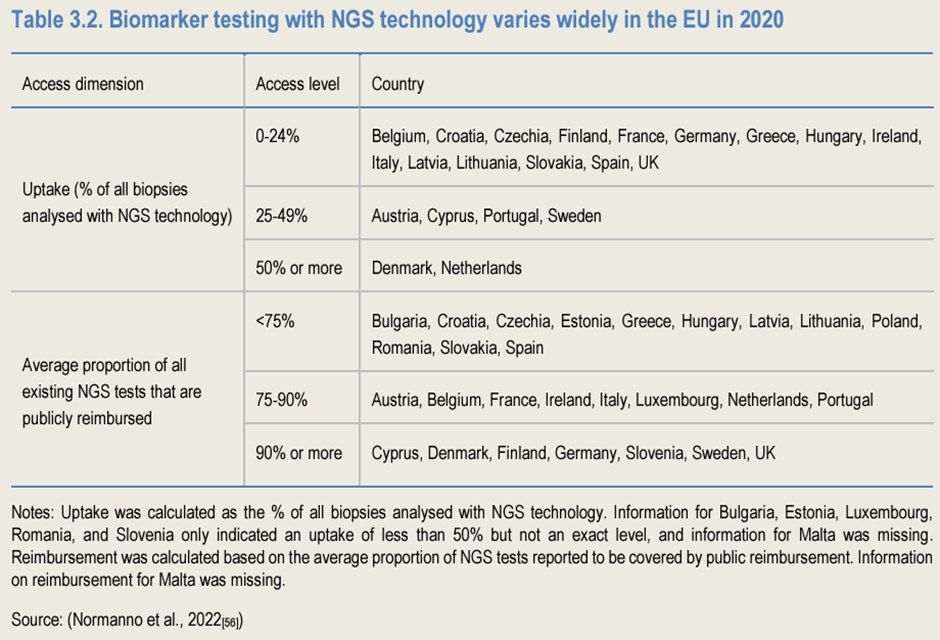
Primjena ciljanih terapija zahtijeva prethodno testiranje prisutnosti različitih „ciljeva“ (tzv. prediktivno testiranje biomarkera). Testiranje omogućuje identifikaciju podskupina pacijenata za koje se očekuje da će imati kliničku korist od terapije. Dijagnostički test koji se koristi za identifikaciju prikladnih pacijenata za određeni lijek naziva se “prateća dijagnostika” (eng. companion diagnostics). Tehnologije koje se koriste za testiranje biomarkera doživjele su promjene u posljednjem desetljeću, odmaknuvši se od analize pojedinačnih biomarkera (jednog po jednog), na paralelno sekvenciranje biomarkera s tehnologijom sekvencioniranja sljedeće generacije (NGS) (Schwartzberg et al., 2017 [52]; Tsimberidou i sur., 2020[53]).

U odlukama o cijenama i financiranju troškova za nove lijekove/indikacije stoga je ključno uzeti u obzir prisutnost prateće dijagnostike. Prethodna istraživanja ukazala su na paradoksalnu situaciju u kojoj obveznici javnog zdravstva mogu odlučiti plaćati lijek, ali ne i njegovu prateću dijagnostiku (Mateo et al., 2022.).
Ukoliko pacijenti ne mogu imati neometanu dostupnost pratećoj dijagnostici, bit će teško imati i dostupnost ciljanoj terapiji, premda je osigurano njezino financiranje. Prema OECD-ovoj anketi o politikama liječenja raka iz 2023., većina zemalja navela je da pokrivenost/naknada troškova prateće dijagnostike nije automatski povezana s financijskom „pokrivenošću“ lijekova. U europskim zemljama s ograničenom javnom naknadom troškova za prateću dijagnostiku, pacijenti, putem plaćanja „iz vlastitog džepa“, ili proizvođači lijekova (kroz programe podrške pacijentima), mogu osigurati tj. financirati testiranje (Normanno et al., 2022.). Nedostatak zajedničkog procesa nadoknade za lijek i njegovu prateću dijagnostiku može usporiti prihvaćanje “personalizirane medicine” u kliničkoj praksi i potencijalno financijski opteretiti pacijente koji iz svog džepa plaćaju testiranje biomarkera.

U praksi bi se financiranje prateće dijagnostike trebalo odvijati integrirano s financijskom nadoknadom za lijekove uz koje je dijagnostika vezana. Dodatni troškovi i testiranja biomarkera i primjene novog lijeka moraju biti uključeni u HTA proces. Rezultat HTA bi tada bio- ili da su i prateća dijagnostika i lijek financijski nadoknađeni ili da se ništa ne plaća. Ukoliko se financijska nadoknada ne objedini zajedno, usvajanje “personalizirane medicine” u kliničkoj praksi bit će usporeno i potencijalno predstavlja financijski teret za pacijente u tim zemljama.
Osim zajedničke nadoknade troškova prateće dijagnostike s lijekom, zemlje bi također trebale osigurati odgovarajuće javne proračune kako bi svi pacijenti koji ispunjavaju uvjete mogli imati dostupnost takvom dijagnostičkom testiranju i lijeku.
Kako bi se olakšalo usvajanje ovih preporuka u kliničkoj praksi, također je važno ažurirati lokalne kliničke smjernice i protokole, omogućiti kontinuirano usavršavanje kliničkog osoblja te osigurati odgovarajuću infrastrukturu i osoblje za dijagnostičko testiranje i provođenje liječenja.
Access to oncology medicines in EU and OECD countries
[i]Thomas Hofmarcher, Caroline Berchet, Guillaume Dedet, Health Working Papers OECD Health Working Papers No. 170. Access to oncology medicines in EU and OECD countries.
https://www.oecd.org/en/publications/access-to-oncology-medicines-in-eu-and-oecd-countries_c263c014-en.html





